Agenția Medicamentului și Dispozitivelor Medicale dă undă verde vaccinării copiilor de la 12 ani cu serul Pfizer
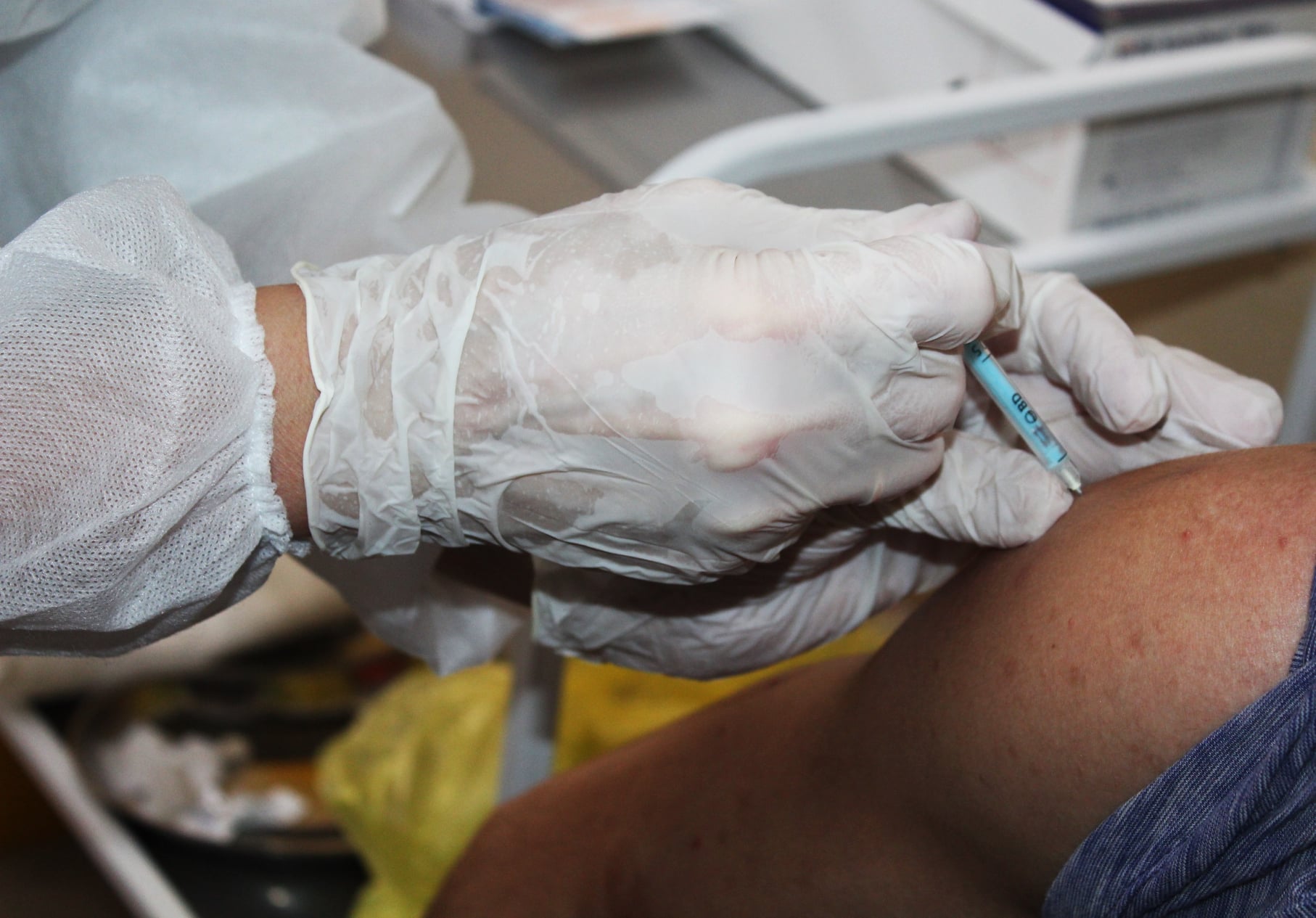
Comisia Medicamentului din cadrul Agenției Medicamentului și Dispozitivelor Medicale a dat undă verde vaccinării copiilor de la 12 ani împotriva noului coronavirus cu serul Comirnaty produs de Pfizer-BioNTech. Despre asta anunță Agenția, printr-un comunicat emis marți, 26 octombrie, în care se mai menționează că AMED a mai aprobat variații la certificatele de înregistrare a vaccinurilor care includ și modificări în RCP (Rezumatul Caracteristicilor Produsului) și în Prospect: Informații pentru consumator/pacient privind vaccinurile anti Covid-19.
Membrii Comisiei Medicamentului au aprobat extinderea indicației pentru vaccinul COVID-19 Comirnaty produs de Pfizer-BioNTech, pentru a include utilizarea vaccinului la copiii cu vârste peste 12 ani.
„Modificările propuse sunt evaluate și înaintate spre aprobare în conformitate cu informația oficială al Organizației Mondiale a Sănătății, referitoare la vaccinurile COVID-19.
Cu referire la vaccinurile Pfizer Comirnaty și Janssen – s-a actualizat profilul de siguranță precum și lista producătorilor de produs finit și substanță activă.
Adițional, pentru vaccinul Pfizer Comirnaty a fost modificat termenul de valabilitate al produsului și anume al flaconului congelat. În varianta actuală acesta este de 6 luni, se propune pentru aprobare varianta de 9 luni – o modificare efectuată de Organizația Mondială a Sănătății”, a menționat șefa secției farmacovigilență și studii clinice, Ecaterina Guzinschi, în cadrul ședinței.
Tot ieri, Comisia Medicamentului a autorizat 57 de produse farmaceutice. Primar au fost autorizate 26 de medicamente. Printre noile produse aprobate, în premieră, de către Comisie se regăsesc medicamente precum:
Ozempic – soluţie injectabilă, produs de compania Novo Nordisk (Danemarca), un nou produs medicamentos indicat bolnavilor ce suferă de diabet zaharat;
Orabloc – un nou tip de anestezic local, produs de compania Pierrel Pharma S.r.l. (Italia);
Salbutamol – produs medicamentos antiasmatic, fabricat de compania Jewim Pharmaceuticals (Shandong) Co. Ltd., (China);
Povidon-iodin – un antiseptic şi dezinfectant, fiind un medicament ce conțin iod, produs de compania Farmaprim SRL ( Republica Moldova );
Startum pulbere şi solvent pentru soluție injectabilă – reprezintă vitamine\multivitamine în combinație și este fabricat de compania World Medicine LTD (Georgia);
Oseltamivir Avexima – un nou tip de produs medicamentos antiviral, produs de compania Avexima SAD (Rusia);
Între timp, Comisia a autorizat repetat 24 de produse farmaceutice. Din această categorie fac parte medicamente precum Finalgon, un preparat pentru dureri articulare şi musculare, produs de Opella Healthcare Romania SRL; antibioticile Roclarin, fabricate de către Antibiotice SA SC România, dar și Maxitrol, care este produs antiinflamatoar şi antiinfecţios, fabricat de Novartis Pharma AG, Elveţia.
Totodată, Comisia Medicamentului din cadrul Agenției a aprobat 577 de modificări postautorizate pentru 139 de medicamente.
La fel, cu votul majoritar al membrilor Comisiei, a fost întreruptă procedura de autorizare în cazul a 34 de produse medicamentoase. Acest lucru a fost cauzat de un șir de factori, inclusiv neprezentarea corespunzătoare a pachetului de documente, dar și neînlăturarea obiecțiilor înaintate de către experții Agenției în termenii stabiliți de Lege.
Agenția Medicamentului și Dispozitivelor Medicale este regulator național în domeniul medicamentelor și dispozitivelor medicale, aflată în subordinea directă a Guvernului. Printre misiunile de bază ale Agenției se numără și cele din domeniul autorizării medicamentelor. Mai exact, AMDM organizează şi monitorizează expertiza, omologarea şi înregistrarea medicamentelor; perfectează, aprobă şi eliberează solicitanţilor certificate de înregistrare a medicamentelor; decide asupra suspendării sau retragerii certificatului de înregistrare a medicamentelor, conform procedurii stabilite de Legea nr. 235-XVI din 20 iulie 2006 cu privire la principiile de bază de reglementare a activităţii de întreprinzător.




